edta滴定法测定水的硬度的原理是什么
来源:企来检时间:2025-03-09
EDTA滴定法测定水硬度的原理是利用乙二胺四乙酸与水中的钙、镁离子形成稳定的络合物。通过准确滴定,根据EDTA与硬度离子的摩尔比关系,计算出水样中硬度成分的含量。

一、EDTA滴定法测定水硬度的原理
EDTA滴定法测定水硬度的原理是利用乙二胺四乙酸与水中的钙、镁离子形成稳定的络合物,通过滴定的方式测定水中钙、镁离子的含量,计算出水的硬度。
1、EDTA与钙、镁离子的反应
EDTA是一种多羧酸,具有4个羧基,可以与钙、镁离子形成稳定的络合物。其反应式如下:
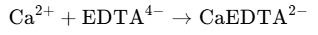
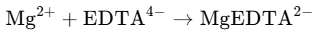
2、指示剂的选择
在滴定过程中,需要加入适当的指示剂,以判断滴定终点。常用的指示剂有铬黑T、钙红等。当EDTA与水中的钙、镁离子反应完全后,指示剂会与剩余的钙离子形成红色络合物,从而判断滴定终点。
二、EDTA滴定法测定水硬度的步骤
1、样品的采集与处理
采集水样后,需要进行适当的处理,以消除干扰因素。将水样过滤,去除悬浮物和颗粒物。然后,加入适量的pH调节剂,将水样的pH值调节至10-12,以保证EDTA与钙、镁离子的反应充分进行。
2、滴定前的准备
在滴定前,需要准备一定浓度的EDTA标准溶液和指示剂溶液。将EDTA固体溶解在去离子水中,配制成一定浓度的标准溶液。同时,将指示剂溶解在去离子水中,配制成指示剂溶液。
3、滴定过程
将处理后的水样倒入滴定瓶中,加入适量的指示剂溶液。然后,用EDTA标准溶液进行滴定。在滴定过程中,要不断摇动滴定瓶,使反应充分进行。当水样的颜色由蓝色变为红色时,即为滴定终点。
4、数据处理与计算
根据滴定过程中消耗的EDTA标准溶液的体积,可以计算出水样中钙、镁离子的含量。根据以下公式计算水的硬度:
硬度(mg/L)=(消耗的EDTA体积×EDTA浓度×换算系数)/水样体积
三、EDTA滴定法测定水硬度的注意事项
1、样品的采集与处理
在采集水样时,要避免污染,确保水样的代表性。在处理水样时,要注意pH值的调节,以保证EDTA与钙、镁离子的反应充分进行。
2、指示剂的选择
在选择指示剂时,要根据水样的具体情况选择合适的指示剂。不同的指示剂对钙、镁离子的敏感度不同,选择合适的指示剂可以提高测定的准确性。
3、滴定操作的准确性
在滴定过程中,要保证滴定操作的准确性。滴定速度要适中,过快或过慢都会影响测定结果。同时,要确保滴定瓶的清洁,避免杂质的干扰。
4、数据处理的准确性
在数据处理时,要确保计算的准确性。要根据消耗的EDTA体积和浓度,准确计算出水样中钙、镁离子的含量,从而得到准确的水硬度值。




















 微信公众号: 企来检
微信公众号: 企来检